
SIND SIE BEREIT FÜR IDMP?
Mitte 2016 wird eine neue Reihe von Vorschriften über Produktkonformität mit europäischen Industriestandards für Pharma- und Life-Science-Unternehmen eingeführt. Identifizierung von Arzneimitteln (IDMP; Identification of Medicinal Products) ist ein Rahmen von detaillierten Beschreibungen von Stoffen, Zusammensetzungs- und Dosierungsformen, Produktionsverfahren und Verpackungen. Diese IDMP-Standards erfordern die Identifikation aller pharmazeutischen Produkte nach bestimmten Daten-Standards, die von der ISO (Internationale Organisation für Normung) festgelegt werden. ISO hat fünf IDMP-Standards vorgestellt; diese zielen auf die genaue Identifizierung von Arzneimitteln für den menschlichen Gebrauch mit einem hohen Maß an Sicherheit ab.

Mit Europa als erste Region, die die Standards zur Identifizierung von Arzneimitteln (IDMP) bis zum 1. Juli 2016 übernimmt, läuft die Zeit für Life-Science-Unternehmen, um diesen Standards zu entsprechen, ab. Es wird erwartet, dass die US Food and Drug Administration (FDA) und die japanische Pharmaceutical and Medical Devices Agency (PMDA) der Initiative der Europäischen Arzneimittel-Agentur (EMA) folgen werden. EMA ist die erste Regulierungsagentur, die Life-Science-Unternehmen dazu anhält, den ISO-Normen zu entsprechen. Im Falle der Nichteinhaltung werden Organisationen hohe Geldstrafen auferlegt. Life-Science-Unternehmen müssen daher schnell einen Datenstandardisierungsprozess einrichten, der robust, zuverlässig und flexibel genug ist, um diese unterschiedlichen regulatorischen Anforderungen zu erfüllen.
Die wichtigsten Herausforderungen aus der Perspektive der Umsetzung der Compliance sind:
- Ein enorm straffer Zeitplan. Life-Science-Unternehmen sind verpflichtet, den Anforderungen vor Juli 2016 zu entsprechen. Aber die endgültigen Umsetzungsrichtlinien der EMA wurden erst Ende 2015 zur Verfügung gestellt. Dies lässt Organisationen ein Zeitfenster von weniger als einem Jahr, um den neuen Normen zu entsprechen.
- Die Notwendigkeit, zwischen Geschäftseinheiten zusammenzuarbeiten. Die Produktstammdaten, die erforderlich sind, um die IDMP-Standards zu erfüllen, sind in einer großen Reihe von Geräten und Systemen in Life-Science-Unternehmen und ihren Zulieferern vorhanden.
- Ein massiv unstrukturierter Datenpool. Bisher wurden die meisten Daten den Regulatoren in heterogenen Formaten wie pdf-, doc- und txt-Dateien vorgelegt. Details über Stoffe, wie beispielsweise die Zusammenfassung der Merkmale des Arzneimittels (SmPC), Herstellungslizenzen, Chemie, Dokumente zu Herstellung und Kontrolle (CMC) usw. sind in einer breiten Reihe von Quellsystemen in den Organisationen vorhanden.
In Bezug auf den letzten Punkt sind Text-Mining-Technologien von entscheidender Bedeutung für die Bewältigung der Komplexität und Heterogenität von unstrukturierten Daten. Text-Mining bezieht sich auf den Prozess der Ableitung hochwertiger Informationen aus einem Text; ein Prozess, der in der Lage ist, schnell relevante Informationen aus Textquellen zu extrahieren und heterogene Daten in verschiedenen IDMP-relevante Quellen, wie SmPC Dokumente, zu strukturieren. Relevante Informationen umfassen Produktnamen, Inhaltsstoffe, Hilfsstoffe, pharmazeutische Darreichungsformen, Stärken und Einheiten unerwünschte Nebenwirkungen und vieles mehr. Diese Informationen werden einem standardisierten Vokabular zugeordnet, wie in den oben genannten ISO-Normen festgelegt und wie in der folgenden Abbildung dargestellt.
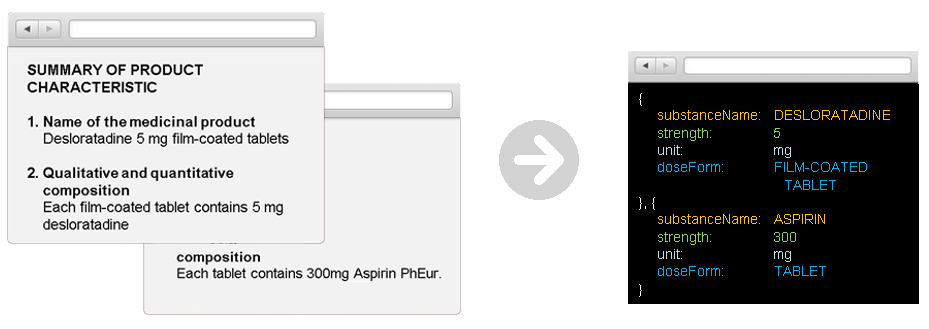
Nehmen wir unerwünschte Nebenwirkungen als Beispiel, um die Komplexität der Aufgabe und die Fähigkeiten der fortschrittlichen Text-Mining-Lösungen zu zeigen. Nebenwirkungen sind in der Regel in Abschnitt 4.8 „Nebenwirkungen“ von SmPC-Dokumenten aufgeführt. Sie liegen meist in verschiedenen Tabellenformaten vor, können aber auch in einer Textstelle gefunden werden. Nebenwirkungen werden kodiert / dem MedDRA-Vokabular zugeordnet. Die für die Extraktion beabsichtigten Informationen bestehen aus mehreren Elementen aus der Tabelle. Beispielsweise werden Nebenwirkungen in der Regel im Zusammenhang mit ihrer Systemorganklasse (SOC) und Häufigkeit aufgelistet. Text-Mining-Lösungen müssen in der Lage sein, solche komplexen Informationen und Beziehungen aus Tabellen zu extrahieren und sie automatisch den MedDRA-Codes zuzuordnen.
Wenn eine Text-Mining-Lösung in der Lage ist, diese Anforderungen mit hoher Präzision zu erfüllen, dann wird sie pharmazeutischen Unternehmen eine Menge Zeit und Geld sparen. Sie schafft eine einheitliche und homogenisierte Reihe von Produktstammdaten und ermöglicht eine signifikante Analyse. Dies liefert neue Erkenntnisse in Bereichen, wie z. B. Überwachung nach der Markteinführung, Konkurrenzanalyse, Lieferkette und Vertrieb / Marketing. Aufwendungen im Zusammenhang mit der Verwaltung, Integration, Wartung und der Abstimmung von Daten über Funktionen und Standorte hinweg werden reduziert.
Averbis bietet Lösungen, die es Unternehmen ermöglichen, IDMP in der vorgegebenen Zeit zu entsprechen und Datenressourcen zu nutzen. Bitte kontaktieren Sie uns, um mehr zu erfahren.

